安全データシート According to JIS Z 版 503 改訂日 1 化学品及び会社情報 製品名アセトアニリド水と徐々に反応して酢酸になる。 酢酸ナトリウム c 2h 3o 2na = 981、無色の結晶。吸湿性で水に可溶。 アセトアニリド c 8h 9no = 135:無色板状晶(水から再結晶)、融点113–114 oc。水に難溶。 5 使用器具(貸し出し器具)手で触れられるほどの温度になったら、水で冷やして再結晶させる。析出したアセトアニリドは実験操作Aと同様に吸引ろ過し、水分を取り除いた後に精製量(収量2 *2 )を測定する。 *2;収量2は粗製アセトアニリドから精製した量。
Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id
アセトアニリド 結晶 考察
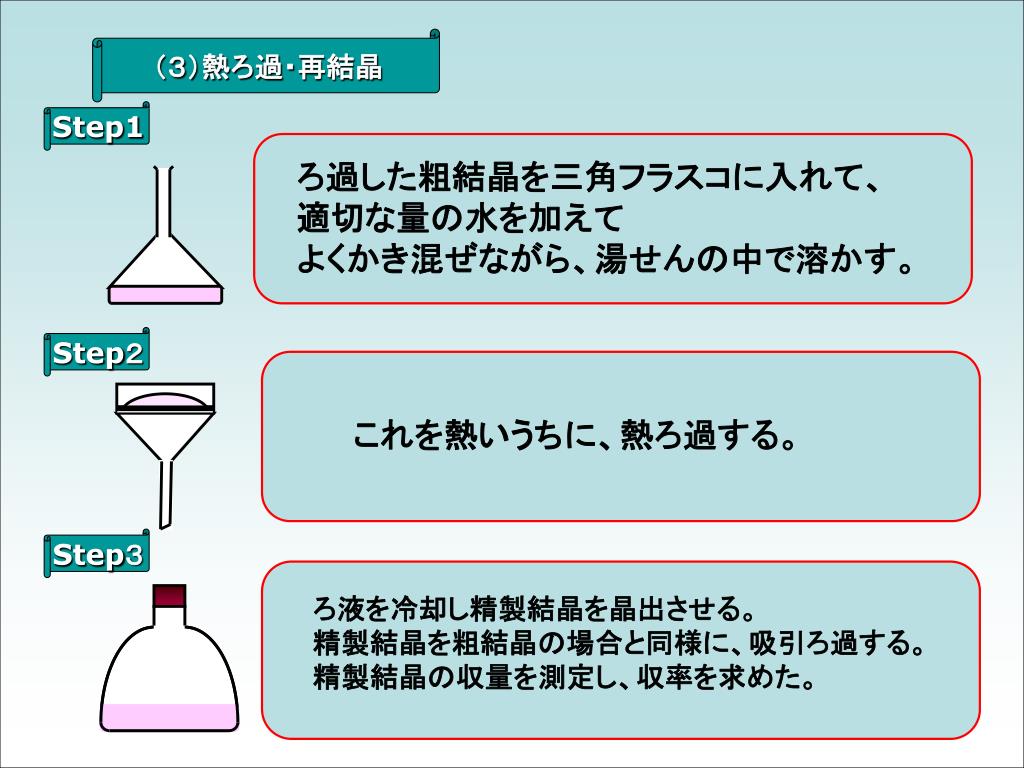
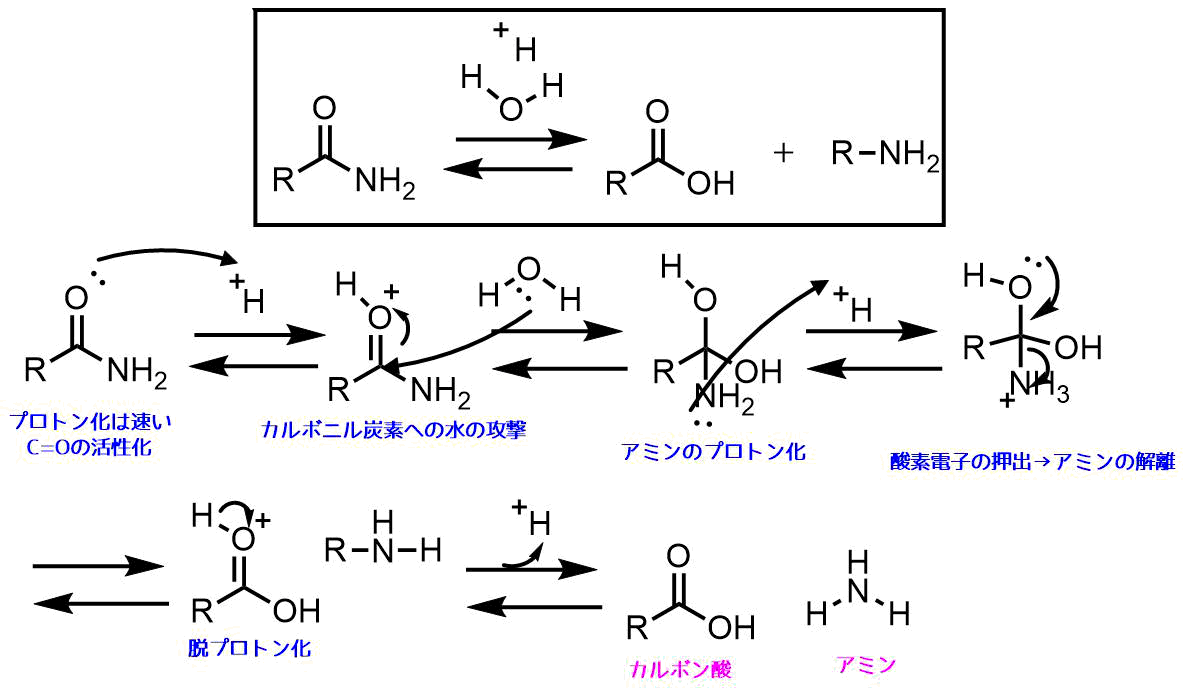
アセトアニリド 結晶 考察-氷冷し、かき混ぜるとアセトアニリドの結晶が得られる。 (7) このとき得られたアトアニリドを吸引ろ過する。沈殿物を少量の冷水で洗い、乾燥させる。 (8) 100mlの三角フラスコに水を約30ml入れ、沸騰させる。これに (7)で生成した粗結晶を加えて溶かす。 · アセトアニリドの合成において、結晶に水が混ざった場合、収率は増え、融点は下がりますか? 収率は増えない。 不純物の水が含まれていれば、その分だけ純粋なものよりも重くはなる。しかし、それは収率が増えたとは言わない。
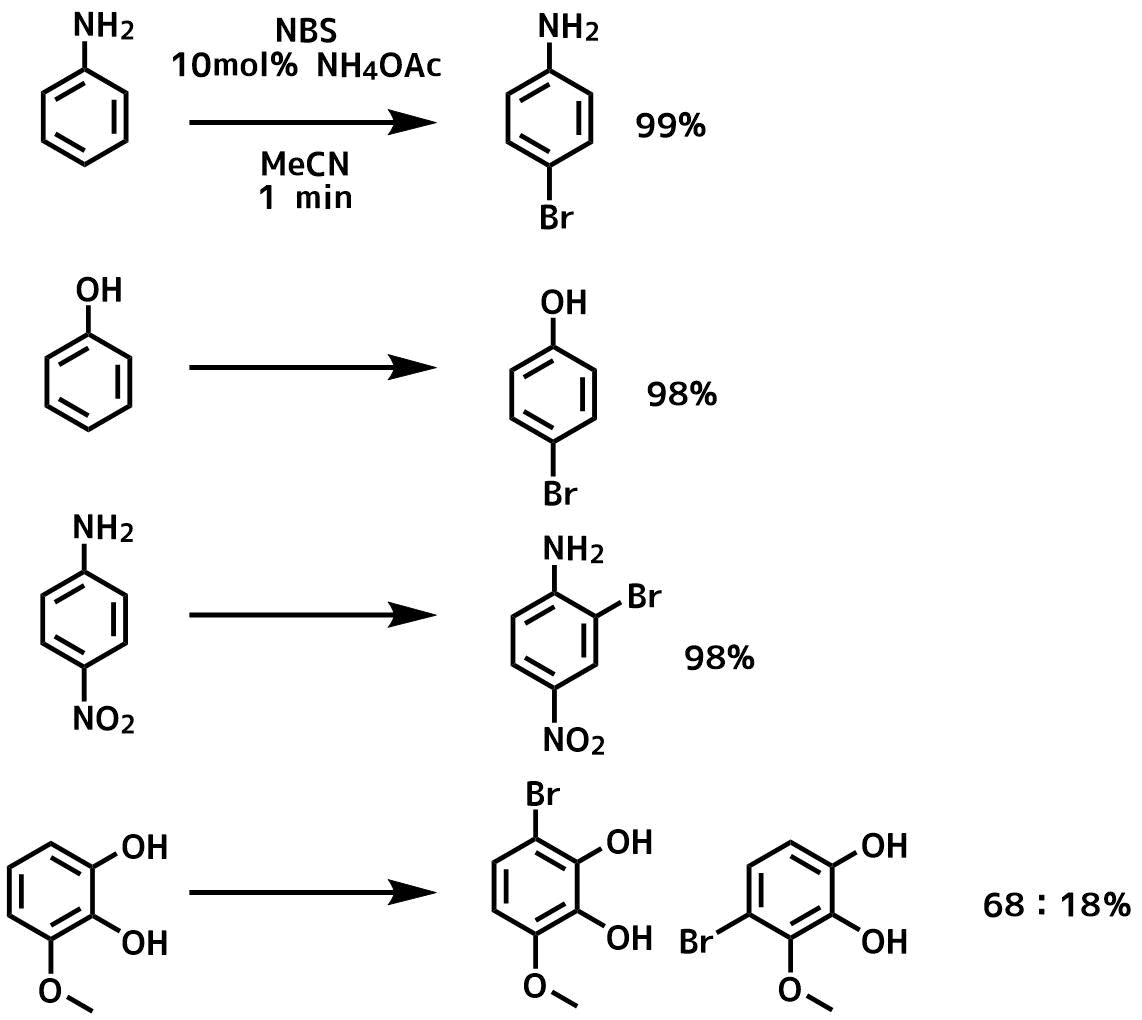



芳香環の臭素化 ネットdeカガク
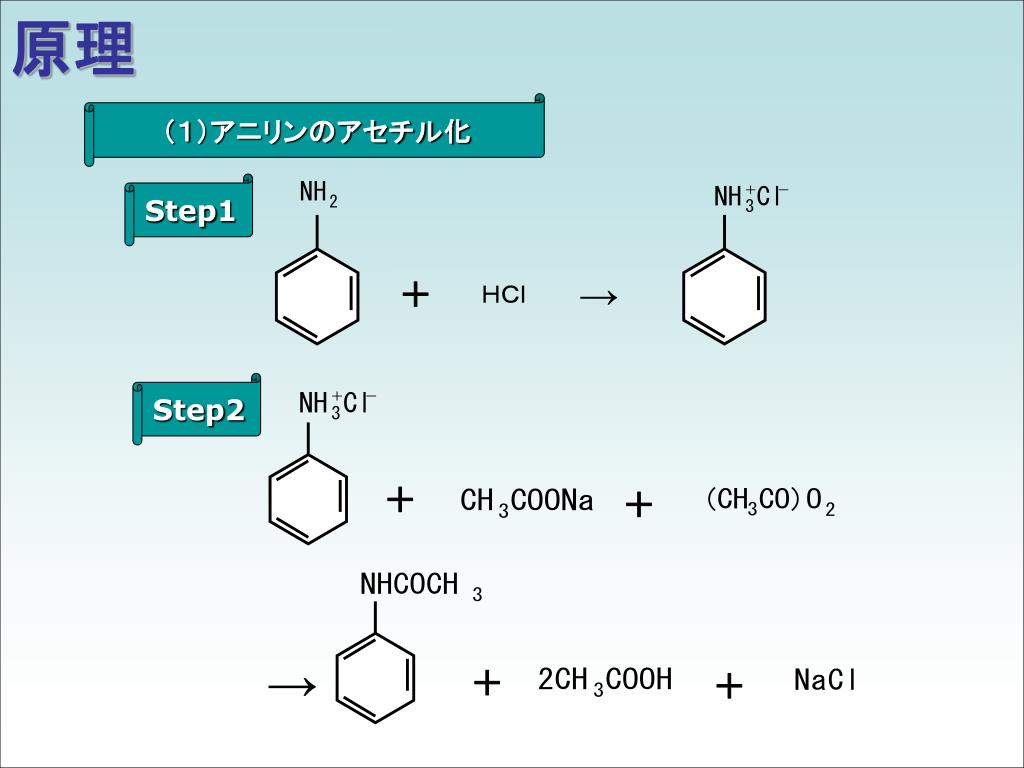
· アセトアニリドはアニリンに無水酢酸を反応さることで合成できて、アニリンのNH2がNHCOCH3になったものである。 まずアニリン水溶液に塩酸を加え、続いて無水酢酸、酢酸ナトリウム水溶液を加えてかき混ぜる。 ちょっと結晶が出てきたら、氷水で冷やしてさらに混ぜ混ぜ。 これで出てきた結晶がアセトアニリドである。 これを吸引濾過して回収すると、この本実験は、アニリンのアセチル化によるアセトアニリドの合成を行うこと、再結晶による精製を行うこと、粗結晶と精結晶の融点測定から合成物質の同定を行うことを目的としたものである。 緒言 有機合成とは アセチル化とは 再結晶とは 融点測定とは 実験 関連物質の物性 使用器具 実験 · アセトアニリド (分子量 ) gの結晶が出来ました。 テキストに結晶の収率算出の方法が書いてあるのでここに書きます。 (収率算出) 原料となるアニリンと無水酢酸のどちらか少ない方のモル数分だけアセトアニリド (分子量)が理論上生成する。 (1)原料 (ml)×密度/原料の分子量=原料のモル数A (mol) (2)Amol×アセトアニリドの分子量=理論上生成する
14熱時ろ過と再結晶 概要・一般的注意 動画は有機化学実験において実習する,次の反応で生じる4メトキシ2ニトロアセトアニリドを例にとって,「熱時ろ過と再結晶」を説明している. 微量の不純物を含む結晶性の試料を精製する方法である.アセトアニリドの合成と精製、融点測定 本実験は、アニリンのアセチル化によるアセトアニリドの合成を行うこと、再結晶による精製を行うこと、粗結晶と精結晶の融点測定から合成物質の同定を行うことを目的としたものである。 緒言 有機合成とはアセトアニリドを合成して、精製前と精製後の融点を測りました。 精製前は不純物が含まれているので融点が低くなると思うのですが、結果は アニリンの融点 粗製物 精製物 一回目 1135~1150 1130~1145 二回目 1145~1155 1135~115 とあまり変わりませんでした。
白桃色の大きな結晶 精製合成物 115℃ 白色結晶の針状結晶 3)出発原料アニリンを基準として、未精製および精製アセトアニリドの化学収率をそれぞれ計算し実収量が理論収量に到達しなかった理由。 アニリンは11×10^2mol用いられている。 アニリン1molからアセトアニリド1molが生成されるので アニリンは11×10^2molからはアセトアニリド11×10^2molが生成さアニリン 酢酸 アセトアニリド 4.再結晶 適当な溶媒に固体物質を溶かし,温度差などを利用して過飽和状態をつくり,徐々に結晶を成長さ せる.分子が規則正しく配列して結晶ができるので,分子の形や大きさの違う不純物は結晶粒の外へアセチルサリチル酸は無色無臭の板状または針状の結晶で、融点は135℃である。(サリチル酸 の融点は159℃)また、水には溶けにくい(1g/300mL(25℃))が、エチルアルコールには溶けやすい。 (1g/5mL) 3 実験方法



Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id




Jpa Crystal Form Of Dmxaa Sodium Salt Google Patents
1811 · 実習担当の先生によると、 この結果から考察を考えたいのですが、粗結晶には不純物があり再結晶ではそれが無くなっている事は分かるのですが、より詳しく知りたいです。分かるかた教えてください。, アセトアニリドの合成するときに用いる、化学物質についての質問です。② アセトアニリドの粗結晶が析出したら,30mlの純水を加えて十分に撹拌する。さ らに結晶が析出するだろう。 (精製) ③ 吸引ろ過し,数回水洗いした後,結晶を0mlビーカーに入れる。C2H3O2Na = 981、無色の結晶。吸湿性で水に可溶。 アセトアニリド C8H9NO = 135:無色板状晶(水から再結晶)、融点113–114 oC。水に難溶。 5 使用器具(貸し出し器具) 三角フラスコ 30 mL 1個、50 mL 1個、100 mL 2個、0 mL 1個




Woa1 除草剤耐性を有する形質転換植物 Google Patents




Jpa Crystal Form Of Dmxaa Sodium Salt Google Patents
D再結晶法による合成物の精製と融点測定 粗合成物+ビーカー |←エタノール+ヘキサン 約ml |←ろ紙でふたをする。 |加熱・沸騰 heat3→heat10 ↓ 結晶析出 ↓ 静置放冷 約分 ↓ 吸引ろ過・乾燥 ↓ 粗合成物・合成物の融点測定得られた粗アセトアニリドを希酢酸(酢酸:水= :2,体積比)約 25mlに穏やかに加熱しながら溶かして放冷する。さらに氷冷して,結晶を析出させる。先と 同様に吸引ろ過をして,水洗し,圧搾する。さらにペーパータオル等で結晶から水分を除去し,この実験では、アセトアニリドのニトロ化反応を行い、続いて、ニトロアセトアニリドの加水 分解により pニトロアニリンを合成し、薄層クロマトグラフィー(TLC) で oニ トロアニリンが副生したこと



ニトロ化反応の条件とやり方 ネットdeカガク




アセトアニリド 合成 なぜ酢酸ナトリウム
結果と考察 〈実験Ⅰ〉 反応時間と温度による収率の変化 粗結晶 再結晶 <実験Ⅰにおける考察> 温度が高いと反応速度が上がり、生成物の量が増えると予想していたが、反応時間10分では逆 に温度が高いほど収率が低かった。2101 · 1分子のアセトアニリドはアニリン1分子と無水酢酸1分子からできます。 つまり、1molのアセトアニリドは1molのアニリンと1molの無水酢酸から合成されます。 再結晶によって得られたアセトアニリドの収率を計算するには 理論収量 を計算しておく必要があります。 理論収量は完ぺきに反応がうまくいったらどのくらいのアセトアニリドが得られるか? という23 個の粒子の集団ですから(アボガドロ数),例えばアセトアニリド1mgはC 8 H 9 NO=から計算して, 6×10 23 ×(1×103 /) =6×10 / =44×10 18 と言う数(44兆の百万倍)の分子になります.耳掻き一杯にも満たない物質量ですが,驚くべき数の集団です.これに比べると地球上の人口の50億




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




18 号 抗菌化合物 Astamuse
実験1 アセトアニリドの再結晶 操作① 低純度のアセトアニリド1g と水30mL を100mL の三角フラスコに入れる。これをセラミック 金網上で沸騰するまで加熱し、沸騰した状態でアセトアニリドが完全に溶解するまで、 水を過剰になり過ぎないように添加する。使用レて計算した。ただし,o一一 Aトロアセトアニリド:oo, o一 チルアセトアニリドおよび。一一ヒドβキシアセトアニリドは90。 した。 3 結果および考察 3。1スペクトルの帰属 環炭素の帰属はSavitsky則を適用して行なった。すでに多く2 dager siden · 考察 アニリンに加えられた三つの試薬のうち、直接アセトアニリドの合成反応に関与するのは無水酢酸である。 塩酸はアニリンを塩酸塩として水に溶かすために加え、酢酸ナトリウム水溶液はアニリンを遊離させて無水酢酸への求核反応を可能にさせるために加えたと思われる。




Jpa Crystal Form Of Dmxaa Sodium Salt Google Patents




再結晶の収率の計算ってどうやるの ネットdeカガク
アニリンとアセトアニリドの違い との差 アニリンおよびアセトアニリドは窒素含有有機化合物である。 それらは非常に異なる化学的および物理的性質を持っています。 アニリンはさまざまな産業で多くの用途があります。 アニリンは、アミン基に結合アセトアニリド (acetanilide) は、アミドの一種で、フレーク状の外見を持つ無色の固体。 Nフェニルアセトアミド、アセタニルなどとも呼ばれる。アンチヘブリンという名称でかつて解熱鎮痛剤として用いられていた有機化合物。 合成 アセトアニリドは、アニリンを無水酢酸と反応させてスパーテルで半さじ分ほどの結晶をサンプル瓶(10 ml)にとり、05 mlの1,2ジクロロエタンを加えて溶かす。広口瓶へ深さが約5 mmぐらいになるように1,2ジクロロエタンをいれて密栓しておく。 垂直に軽く接触させて 試料溶液をTLCシートに浸み込ませる。




Ppt アセトアニリド Powerpoint Presentation Free Download Id



燃焼イオンクロマトグラフィーによる有機化合物中のハロゲン及び硫黄の高速一斉分析 エイミック トレーディング
物から分別結晶によりp−ニトロアニリンを取り出す。この一連の合成反応を実際に経験するなか で、合成法、精製法や生成物分析の基本を理解する。 (1)アセトアニリドの合成 (2)アセトアニリドのニトロ化 (3)ニトロアセトアニリドの加水分解とし,ろ過により アセトアニリド が得られる 。 C6H5NH 3 +Cl - Ê C 6H5-NH 2 +(CH 3CO )2O → C6H5-NHCOCH 3 + CH 3COOH アニリン は,塩酸塩 の状態 では ,非共有電子対 をもっていないから ,無水酢酸 の電子 · 融点は溶け始めと溶け終わりの2つの温度を測定します。通常 mp = 172℃~174℃ などのように幅があります。純粋な化合物は幅が2℃未満になります。2℃以上の幅がある場合は結晶の純度はあまり高くない可能性が高いです。



新基礎化学実験法 谷洋介 西井祐二 布谷直義 宮崎裕司 山口和也 山田剛司 吉成信人 編集 学術図書出版社 版元ドットコム




化学実験 パラニトロアニリン赤の合成と染色 慶應義塾大学日吉キャンパス 特色gp 文系学生への実験を重視した自然科学教育
· 化学 この前、化学の実験でアセトアニリドの合成を行ったときに、アセトアニリドの精製法として、水からの再結晶法が最も適当であるらしい、ということを耳にしました。これが本当ならば、その理由が分からない「アセトアニリドの合成」 目的 アセトアニリドを合成して収量を測定する。アセトアニリドの粗結晶を再結晶させてその融点を測定する。 原理 アニリン C6H7N,分子量9313。特異臭のある無色の液体。融点-6℃、沸点184℃、71℃。水蒸気蒸留できる。比重d,屈折率nD気化熱1139cal・g1のかを考察する。 ※アセトアミノフェンについて 構造式は以下のとおりである。解熱鎮痛薬の一つであり、抗炎症作用を持っていないため、 広く用いられている。 Ⅱ 研究目的 私は化学の授業で有機化合物について学ぶ以前から医薬品に興味を持っていた。
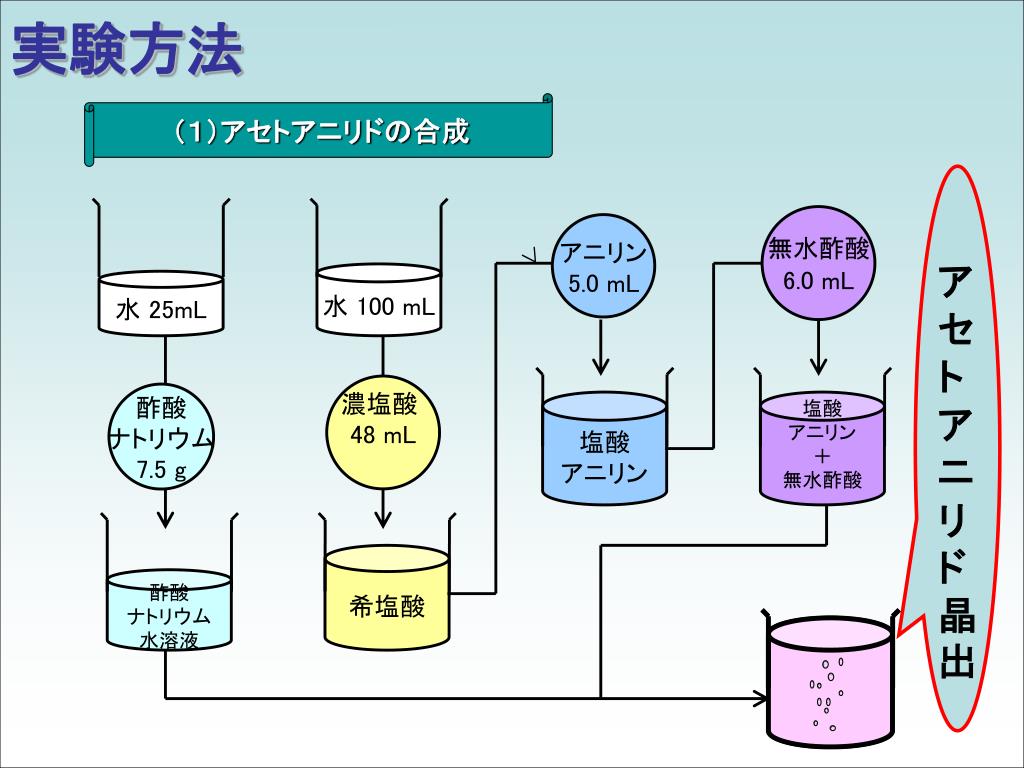



Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id
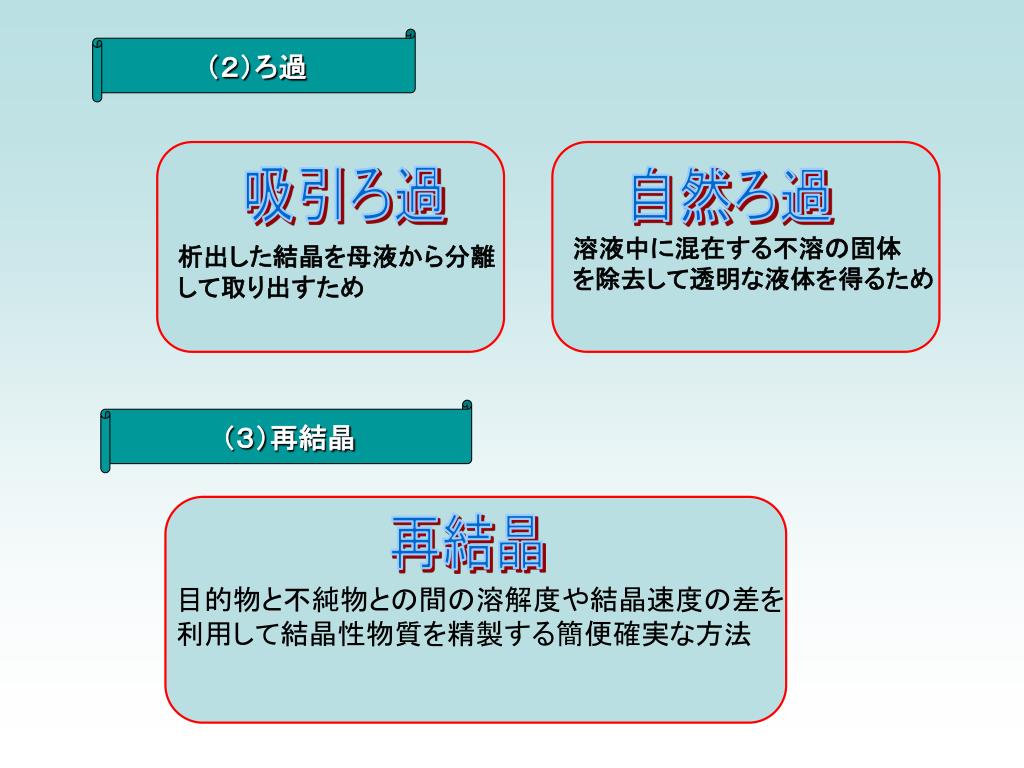



Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id
2501 · 物質の純度を高める方法としては、以前に物質を分離する「ろ過」の方法を学びました。 錬金術入門①純粋な物質を取り出す、ろ過の仕組み 空気の中から窒素を取り出し肥料にする原油からナフサを取り出しプラスチックを作る鉄鉱石から良質の鉄を融点測定 -アニリンと無水酢酸からアセトアニリドを合成し、再結晶法により精製- 実験日 7月4日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:曇り 気温:232℃ 湿度:598% 目的 アニリンと無水酢酸からアセトアニリドを合成し、再結晶法により生成物を精製し、収率を計算する。(3)ろ過して結晶を取った後の液にさらし粉水溶液を加えると 未反応のアニリンが反応する場合は紫色になる。 (4)できたアセトアニリドは回収する。 考察 (1) アニリンと無水酢酸の反応式を書け。




Jp0557a 昆虫忌避剤としてのジヒドロネペタラクトン Google Patents



再結晶の収率の計算ってどうやるの ネットdeカガク



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校




Jpa Crystal Form Of Dmxaa Sodium Salt Google Patents




アニリン Wikipedia




18 号 抗菌化合物 Astamuse
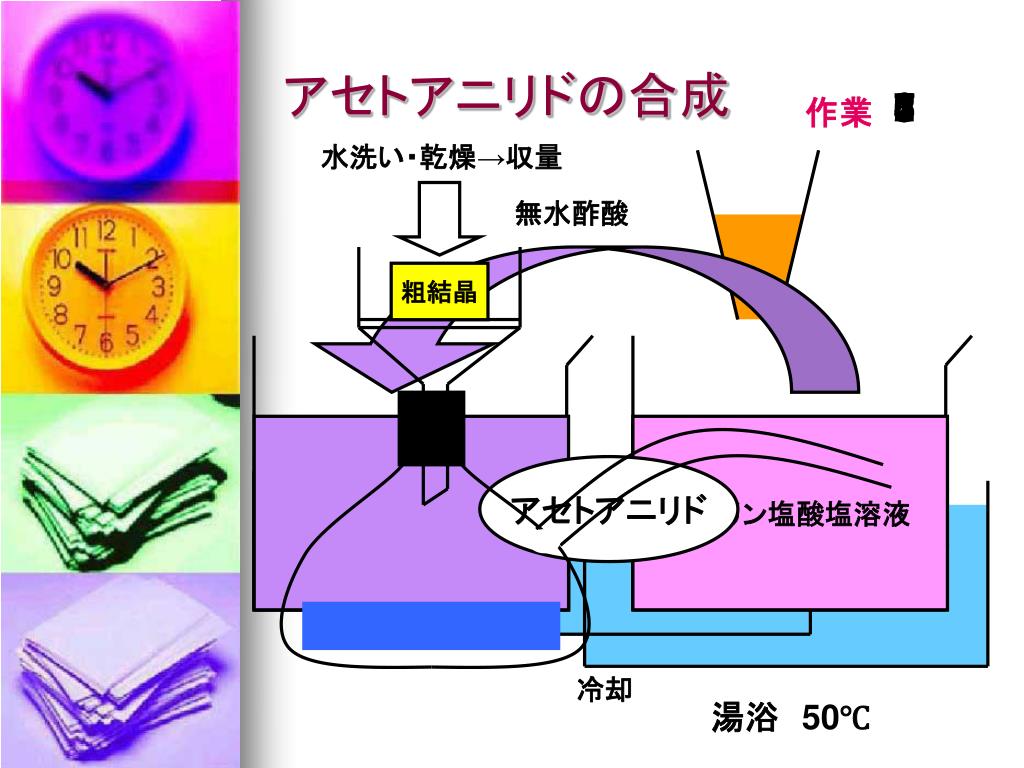



Ppt アセトアニリド Powerpoint Presentation Free Download Id




W9ebvvlavhaerm




アセトアニリド 合成 なぜ酢酸ナトリウム



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校
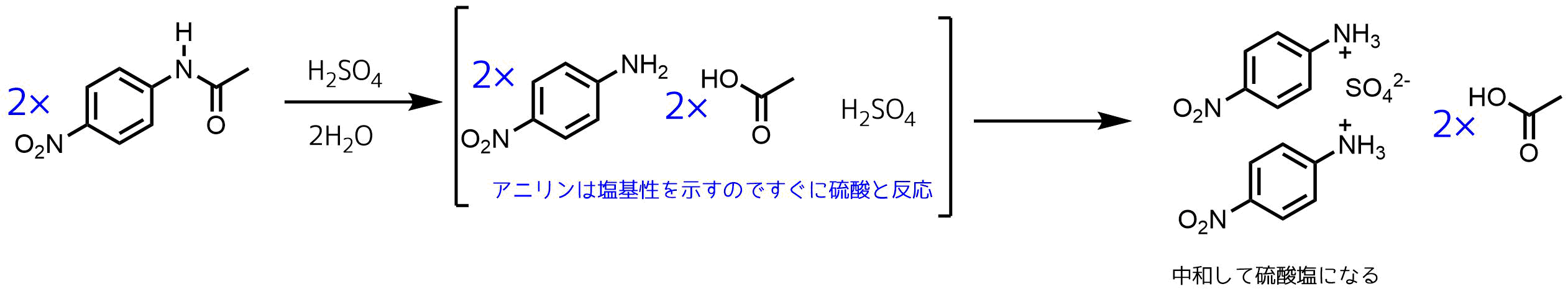



ニトロ化反応の条件とやり方 ネットdeカガク




メカトロニクスコース Manualzz




Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id




Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id




Jpa Crystal Form Of Dmxaa Sodium Salt Google Patents




Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校




芳香環の臭素化 ネットdeカガク




号 光学用保護フィルム Astamuse
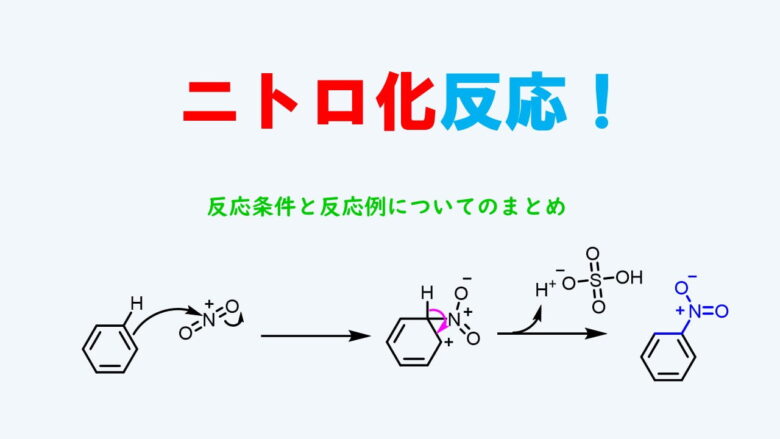



ニトロ化反応の条件とやり方 ネットdeカガク




Ppt アセトアニリド Powerpoint Presentation Free Download Id




Jp0557a 昆虫忌避剤としてのジヒドロネペタラクトン Google Patents



Ppt アセトアニリド Powerpoint Presentation Free Download Id




Jpa Crystal Form Of Dmxaa Sodium Salt Google Patents




18 号 抗菌化合物 Astamuse



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校
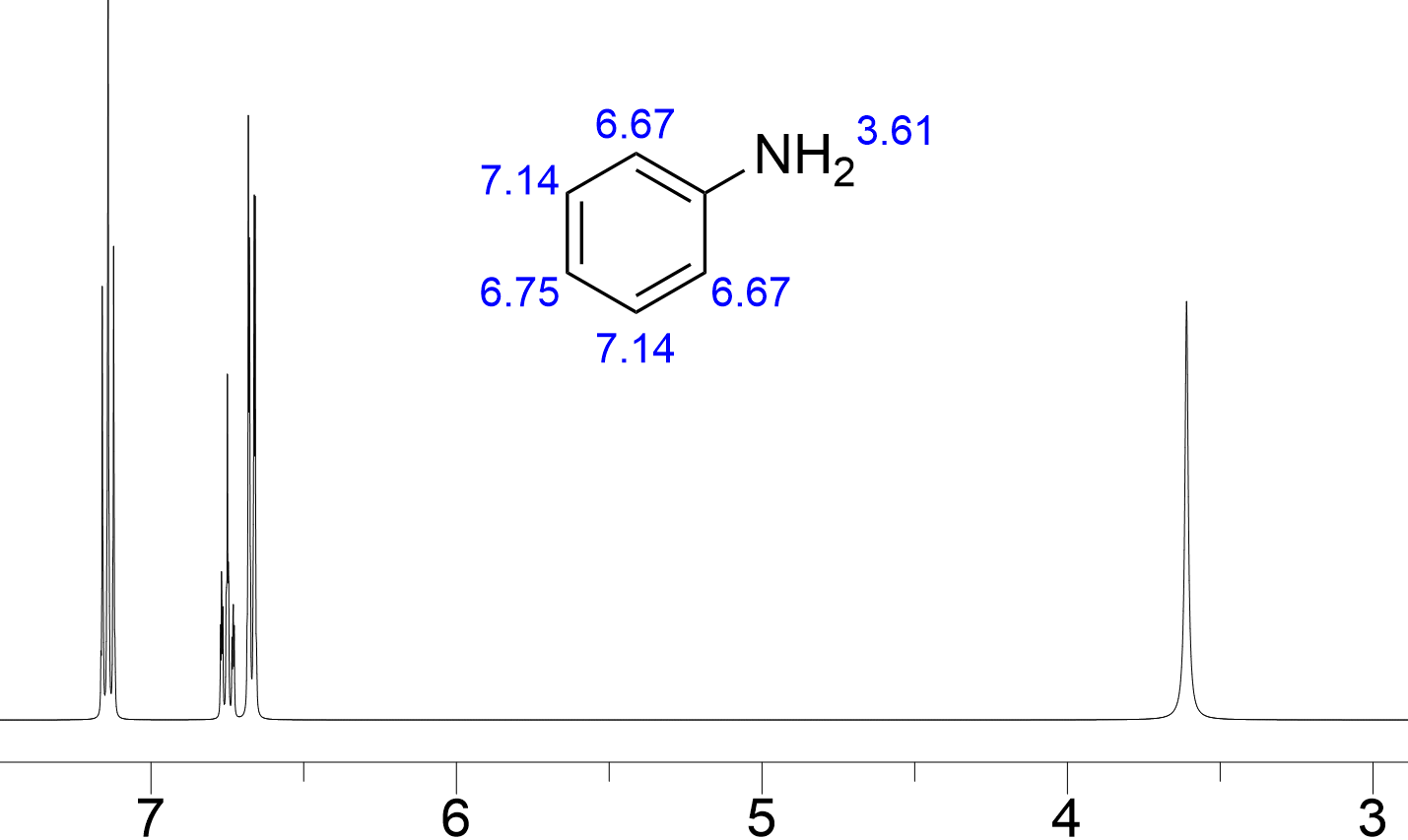



アミンのnmrのシフト値 ピークがブロードする理由などを紹介 ネットdeカガク
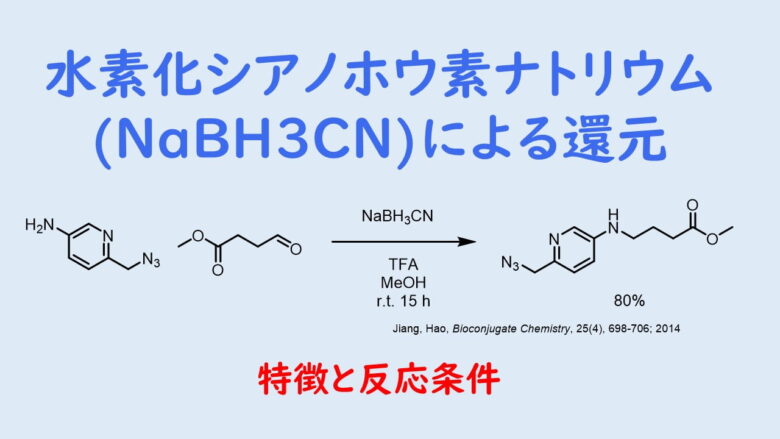



再結晶の収率の計算ってどうやるの ネットdeカガク




Chasing Methodologies That Are Not There 10



粗結晶 に関するq A Yahoo 知恵袋



アセトアニリド 合成 なぜ酢酸ナトリウム



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校
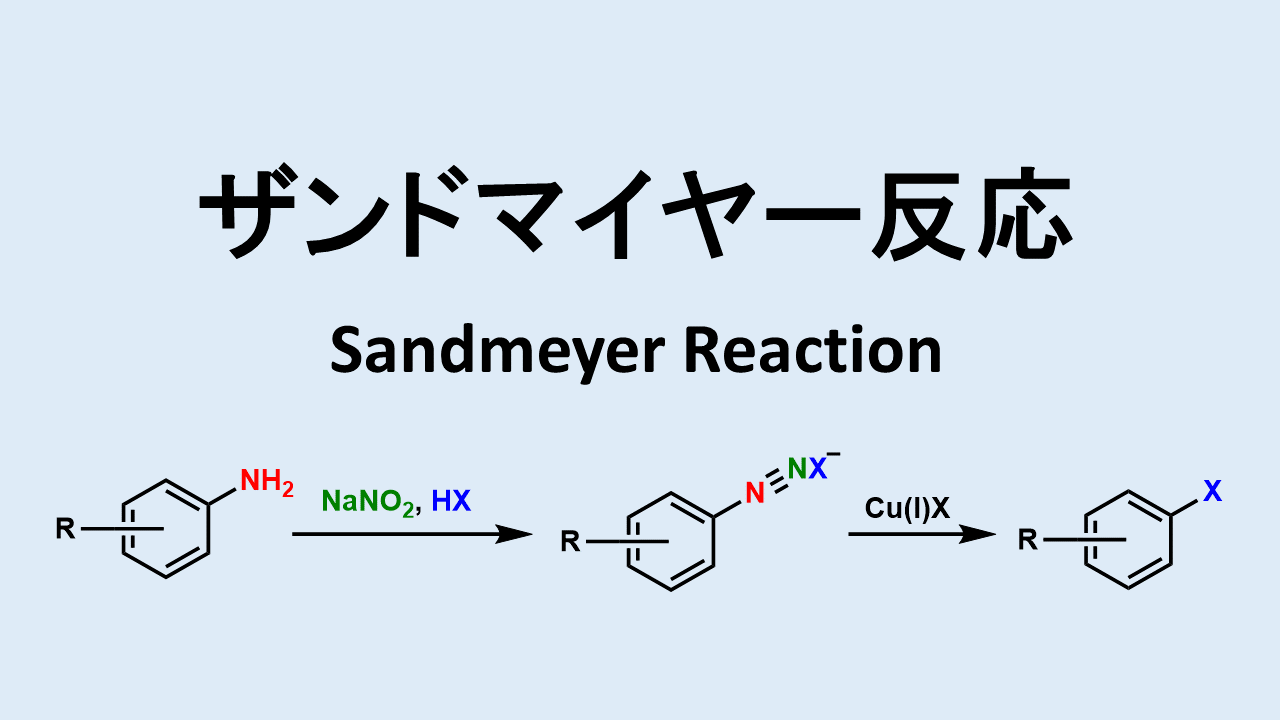



ニトロ化反応の条件とやり方 ネットdeカガク




アセトアニリドの合成 Youtube




Jp0557a 昆虫忌避剤としてのジヒドロネペタラクトン Google Patents




Jp0557a 昆虫忌避剤としてのジヒドロネペタラクトン Google Patents
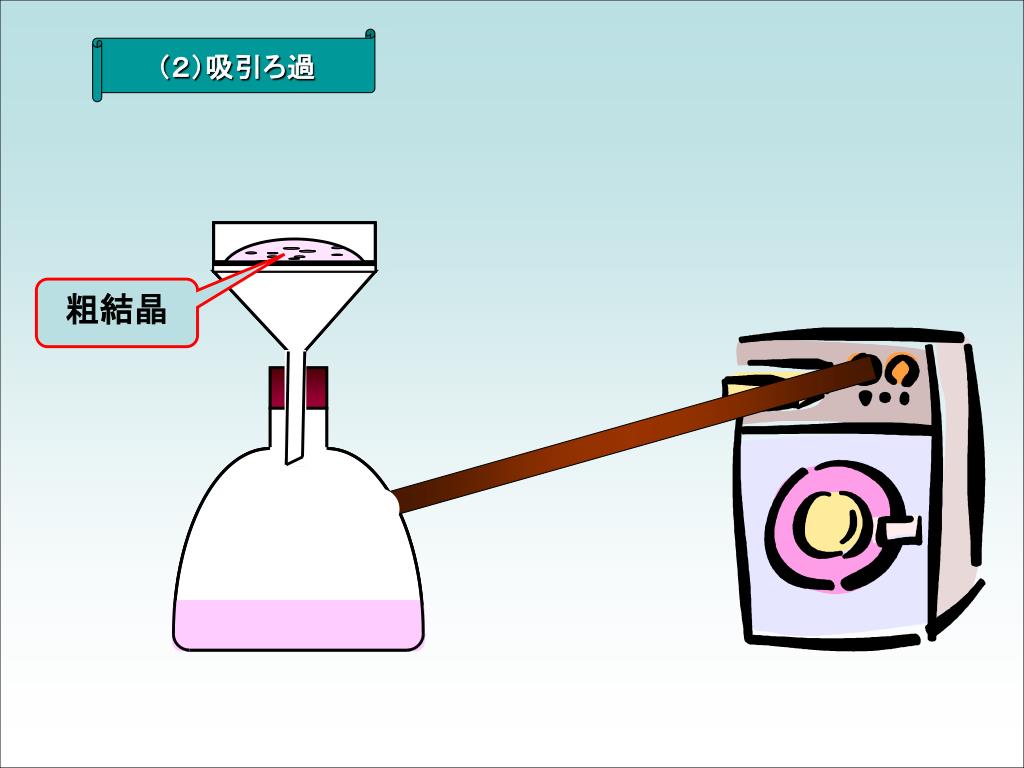



Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id




二酸化炭素の状態変化と分子量測定 二酸化炭素 相図 理想気体の状態方程式 Transblog




Jpa Crystal Form Of Dmxaa Sodium Salt Google Patents




1998 号 可溶性の組合せライブラリー Astamuse




Ppt アセトアニリド Powerpoint Presentation Free Download Id



0 件のコメント:
コメントを投稿